Как получить водород в домашних условиях из воды
Теплоснабжение водородом: перспектива ли?
Водород является самым популярным элементом химии в природе, так как будет примерно 90% от всей массы всех компонентов во Вселенной. При этом в чистом виде он почти не встречается. Чаще его можно выявить в составе разных химических соединений. А между тем он может быть прекрасным чистым в экологическом плане и не вредным топливом для получения энергии. Аналогичным образом, можно обогревать водородом даже свой собственный дом. Особенно радует тот момент, что водородное горючее можно применять, если переделать простой котел на газе в водородный. Однако остаётся основная трудность: где взять чистый водород? В свободном доступе он отсутствует, приобрести его нельзя. Только один выход — генератор для дома водорода. На счастье, его можно либо собрать собственными руками, либо приобрести готовый. Осталось лишь определиться с видом генератора, которые отличаются в зависимости от того, каким вариантом выходит водород.
Получение чистого водорода
Водород можно получить всевозможными вариантами. Вот лишь отдельные из них, являющиеся самыми доступными и популярными:
- Электролиз воды. Самый эффективный способ — высокотемпературный.
- Хим. реакция воды и аллюминиево-галиевого сплава.
- Получение водорода при высокотемпературной отделке угля и древесины.
- Переработка мусора, домашних отходов.
- Выделение водорода через переработку биомассы (навоза, сена, водорослей и других отходов фермерского хозяйства).
Большинство способов базируются на использовании больших температур и, к несчастью, в условиях обыкновенного хозяйства по дому непригодны. Однако существует несколько путей для получения водорода дома.
Ионный водород
Очень доступный и довольно широко популярный способ добычи водорода дома — с помощью реакции электролиза воды. Необходимое оборудование, называемое электролизером, довольно доступно на рынке. При этом среди изготовителей встречаются как именитых гиганты (к примеру, Honda), так и очень маленькие изготовители из Китая или бывших советских республик. И если в случае с первыми в качестве предоставляемой вниманию продукции сомнений не должно быть, то вот вторые часто подводят. При этом не стоит очень смотреть на их светлую и многообещающую рекламу. Недобросовестному изготовителю не стоит ничего сказать про то, что его продукт наиболее качественный, неплохой и надежный на рынке. Однако не все, что он скажет, окажется правдой. Особенно должна настораживать цена, так как генератор не может быть очень не дорогие. Дешевизна может указывать на не высококачественные материалы, использованные во время работы, или экономию на сборке. Установки не дешёвые не спроста, а за счёт гарантии безопасности также. Так как водород считается взрывоопасным, его утечка может принести много бед. Плохого качества шланги, негерметичный накопительный бачок — и все, взрыв гарантирован. Качество выполнения порой может «хромать», так что лучше как то не пожадничать и раскошелиться на прекрасное оборудование.
Неплохой электролизер способен похвалиться качеством, компактностью и легкостью эксплуатации. Его можно поставить в любом уголке помещения и в виде топлива для получения заветного водорода задействовать привычную водопроводную воду- . В большинстве случаев электролизер состоит из риформера, топливных компонентов, системы очистки, нагнетателя воздуха и ёмкости для хранения газа. Электрическая энергия поступает из сети питания. Очень современные модели и совсем оборудованы фотоэлектрическими панелями. Данное оборудование точно быстро оправдается за счёт небольших затрат на его применение, даже беря во внимание не наименьшую стоимость самого агрегата.
Водород из сельскохозяйственных отходов
Нередко во всемирной сети можно повстречать упоминания о биогазовых установках. Смысл их работы сводится к тому, что в генератор загружается навоз, он там перерабатывается и на выходе выходит метан. Естественно, может применяться не только навоз, а любой компостируемый материал. Однако чистый навоз считается наиболее продуктивным и доступным. Получившийся биогаз потом по трубам поступает на нужды хозяйства и применяется как обыкновенный сетевой газ. Но у данного варианта добычи водорода есть пара минусов:
- Водород как такой в этом процессе считается лишь побочным продуктом. Для того,чтобы его разделить, требуется повторная обработка полученного газа. В основном, никто этим не занимается и водород успешно погибает в объятиях пламени одновременно с метаном.
- Нужно постоянное поступление сырья. Другими словами в генератор безостановочно должен поступать навоз, и в значимых количествах. Понятно, что простое приватное хозяйство не сумеет обеспечить постоянный поток сырья. А приобретать его на стороне — не рентабельно. Вывод: подобный вариант получения водорода подходит только относительно большим хозяйствам, готовым предоставлять такие объёмы. Однако им данная установка выгоды не принесёт, разве что даст возможность с пользой для хозяйства избавиться от отходов.
Также, на долю водорода на выходе приходится только лишь 2-12% водорода. Другими словами главная масса продукта — метан. Чтобы давать хозяйство собственно водородом, понадобится неимоверное кол-во сырья и очень большие мощности производства. Так что даже большим хозяйствам невыгодно фокусироваться собственно на выделении водорода. Им нужно будет либо сжигать его одновременно с метаном, что и выполняется В практических условиях, либо пытаться задействовать его также в обиходе. Но для выделения и хранения водорода опять понадобится оборудование дополнительного характера, а это означает, лишние траты. Аналогичным образом, биогазовая установка на данное время считается самым нерентабельным способом добычи чистого водорода.
Изготовление электролизера собственными руками
Расценки на дорогостоящее иностранное оборудование часто отпугивают обычных хозяев малых хозяйств. Как то обжёгшись а недорогом электролизере плохого качества или и совсем решив не бравировать, умельцы думают о самостоятельном изготовлении генератора для дома водорода. В общем, задача осуществимая, при условиях владения некоторыми знаниями и умениями.
Для того, чтобы сделать свой электролизер, придется приобрести и все составляющие установки, которые были указаны выше. К тому же, процесс не завершается на шаге выделения топлива. Ведь ещё необходимо разделить водород от кислорода и пара на воде, обеспечить его постоянный ток, накопление в необходимом объеме и подачу. В результате окончательный подсчёт покажет, что самостоятельная сборка обойдётся не на много доступнее купленного генератора, а вот времени и сил уйдёт неимоверное кол-во. И неизвестно, будет ли результат который получился подходить ожиданиям и справляться с задачей которая поставлена.
Стоимость водорода
Технологии получения водорода воздействуют на его отпускная цена. Итак, отпускная цена водорода за 1 кг по мере возрастания составляет:
- 130 рублей — способом высокотемпературного электролиза на АЭС ;
- 200 рублей — способом конверсии углеводорода;
- 320 рублей — способом химреакции (с АЭС);
- 350 рублей — способом добычи из биомассы;
- 420 рублей — способом электролиза;
- 700 рублей — способом восстановления реагента.
Аналогичным образом, понятно, что самый недорогой вариант добычи водорода — первый, способом электролиза на АЭС при участии больших температур. А дело все в том, что на АЭС большие температуры являются побочным производственным эффектом, на их получение не идёт внеочередных затрат. Однако пока ещё ни один из вариантов получения водорода в качестве топливной энергии не считается полностью окупаемым. Ведь если даже приобрести саму дешевую и при этом эффективную установку, даже в том случае, если не иметь в виду её большую цену, все равно на выделение водорода требуется электрическая энергия. Применяемое электричество формируется на здешних станциях и передаётся по проводам. При этом происходят неизбежные потери энергии.
Есть ли выгода
Есть неправильное представление, что домашнее отопление с помощью водородного топлива обходится едва ли не в копейки. В действительности, подобную идею распространяют изготовители электролизеров и других установок для получения водорода. Словом те, кому подобное мнение выгодно. Они говорят, что стоит всего раз раскошелиться на покупку этой чудо-машины, и живите себе дальше припеваючи и беззаботно. Однако так ли все в действительности?
Нужно только на минутку подумать, чтобы понимать, что в реальности обстоят дела не так весело. Самое первое, сама установка самая дорогая. Если даже собирать аппарат своими силами, расходы на комплектующие обходятся не так уж дёшево. Другими словами первоначальные расходы довольно большие, а перспективы окупаемости — туманны. Второе, для работы электролизера нужна вода из под крана, которая тоже не бесплатна. И третье, нужно брать во внимание расходы на электрическую энергию к примеру, если генератор не работает на батареях которые работаеют от солнечных лучей.
Аналогичным образом, выгоды в применении водорода как топлива для хознужд фактически нет. Возможно, лишь спустя через десяток-два лет, когда технологии станут намного совершеннее, задействовать водородное горючее будет выгодно, чем существующие на текущий момент альтернативные источники. Однако пока что подобный вариант обходится едва ли не в 4 раза дороже. И это с учитыванием не наивысших тарифов на элестроэнергию и воду. Если даже брать средние и самые маленькие значения для России и бывших советских республик, стоимость получаемого топлива необоснованно высока. Благодаря этому применение этого варианта теплоснабжения собственного дома приглянётся разве что ярым природным защитником, ведь водородные установки полностью безопасны.
Будьте осторожны
После того как произошла установка генератора, как и во время, нужно всегда помнить о технике безопасности. Водород считается огнеопасным взрывоопасным газом без запаха, благодаря этому его утечка очень опасна. Чтобы это не допустить, следует внимательно проверить все составляющие электролизатора на непроницаемость: трубки, насос, резервуар. Особенно это можно отнести к самосборным устройствам. Непосредственно они считаются самыми опасными. Более того, неизвестно, насколько хорошее горючее они будут в конце концов подавать. Естественно, возможность брака может быть высокой и у покупных моделей, особенно малоизвестных или непроверенных изготовителей. Благодаря этому всегда предпочтение лучше отдать более дорогому, но и более надёжному изготовителю такого оборудования. Звучит как реклама, но факт остаётся фактом: за качество приходится приплачивать. Хотя работает не всегда правило, что чем дороже, тем лучше. Прекрасно, если потребитель, делая собственный выбор, опирается на знания в этой области. И, самое основное — доверяй, но проверяй. Ведь даже наиболее известный бренд может сделать брак.
Водород дома
На Земля водород в чистом виде практически не встречается, и в обычной жизни мы с ним не встречаемся. Однако в соединениях — это второй по количеству атомов компонент в земной коре после кислорода. Все живые создания на Земля, включая нас с вами, приблизительно на 2/3 состоят из водорода.
Основные слова: водород, получение водорода.
Так что такое водород? Каковы его свойства? Как его получают и используют в земных условиях? Можно ли получить водород дома, и как это сделать прекраснее всего? На эти и остальные вопросы мы попытаемся дать ответ в ходе нашей научной работы.
Водород — это Самый аскетический компонент в природе, который состоит из одного протона и крутящегося около него электрона. Первый раз получение водорода упоминается у английского учёного Роберта Бойля, который в первой половине 70-ых годов XVII века проводил реакцию между металлическими стружками и разбавленными кислотами. Российское название «водород» предложил химик М. Ф. Соловьев в первой половине 20-ых годов XIX века — по аналогичности с «кислородом» М. В. Ломоносова. Официальное латинское наименование водорода «Hydrogenium».
В промышленности водород получают преимущественно из ископаемого топлива. Первоочередно это сетевой газ, метан, с которым очень многие из нас может встретится в кухонной комнате, если вас есть кухонная плита. Водород получают из лёгких фракций нефти. 3-ий по популярности источник водорода — это уголь.
Очень доступным для повторения дома считается разложение воды электротоком (электролиз).
Для проведения нашего эксперимента мы взяли старую зарядку на 5 В 750мА и угольные электроды, извлечённые из обыкновенных солевых батареек. Чтобы провести измерения протекающего тока употреблялся мультиметр.
Для сбора и измерения получающихся газов, в бутылки налили воды, и закрепили их на ключевой ёмкости горлышком вниз, погрузив его при этом в электролит. Поэтому, чтобы воздух в бутылку попадать не смог. Всего в ёмкости и бутылках вышло около 1,5 литров воды. Как и ожидалось, с питьевой водой, после подачи напряжения с устройства для зарядки ничего не случилось. Мультиметр показывал практически нулевой ток. Однако, когда в воду добавили 2 чайные ложки соды, электролиз пошёл бодрее, на двоих электродах стали появляться пузыри газа, а мультиметр показал ток 15 мА. с подобным небольшим током за день (24 часа) получилось собрать только 0,11 литра водорода (приблизительно полстакана). Во второй бутылке при этом собралось приблизительно в несколько раз меньше кислорода. Это значит, что в водной массе водорода вдвое больше, чем кислорода.
Наблюдение выделения водорода в результате взаимного действия металлов с разбавленными кислотами было самых первым в истории химии. И его относительно просто повторить дома. Нам для этого потребуется металл, лучше всего энергичнее и кислота. В нашем эксперименте мы подобрали электролит для свинцовых аккумуляторов, который можно отыскать в ближайшем автомагазине и цинк из использованных солевых батареек. Для сбора водорода, как и в случае электролиза, применяли перевёрнутую бутылку с опущенным в воду горлышком. Электролит дополнительно развели водой в соотношении 50 мл раствора серной кислоты на 150 мл. воды. Цинка из батарейки вышло приблизительно 1 г. За 12 часов весь металл растворился и мы получили 0.7 литра водорода.
Другой распространенный способ — взаимное действие металлов с щелочами. Для эксперимента мы подобрали два вида, которые были рядом — кусочки провода и фольгу для запекания. Щёлочь (гидроксид натрия) можно отыскать в бытовых магазинах как средство для очищения труб канализации (КРОТ, к примеру). Установку для получения применяли практически аналогичную, что и в опыте с кислотой и цинком. Раствор в двоих опытах был одинаковым: 20 мл щёлочи и 200 мл воды. В первом опыте применяли проволоку диаметром 1.5 мм, в другом — кусочки фольги. И в том и другом случае масса алюминия была 1 г. В первом опыте получилось получить 1.2 л водорода, заняло это 34 часа. В другом опыте фольга растворилась за 1 час 20 минут, выделив 1.4 л водорода. Из данных опытов делаем вывод, что скорость реакции сильно зависит от поверхностные площади, на которой она происходит. В опыте с фольгой поверхностную площадь была в несколько раз больше, чем в опыте с проволокой. Ещё большей скорости можно достигнуть, если взять алюминий в порошке. В данном случае соотношение поверхностные площади к массе будет самым большим.
Аналогичным образом, в экспериментах по получению водорода наиболее быстрым и доступным способом оказался вариант взаимного действия фольги на алюминевой основе со щёлочью. Но если нужно получать водород постоянно и в значимых количествах, то на первое место должен выйти электролиз, так как он не просит никаких используемых материалов не считая воды. Правда для этого потребуется более серьёзная установка, чем зарядка от телефона и пара бутылок.
В ходе научной работы мы познакомились с очень популярными, но таким редким в бытовых задачах и целях веществом, как водород. Научились получать его всевозможными вариантами и подобрали самый комфортный для выполнения дома — действие средства для очищения труб, имеющего щёлочь, на алюминиевую фольгу.
Еще мы на своем опыте поняли, что водород — горючий и взрывоопасный газ, но им действительно можно заполнять воздушные шарики, чтобы они летали. Правда при этом стоит держать их дальше от открытого огня.
Как выполнить генератор водорода дома
Водород – очень популярный компонент. Благодаря собственной неповторимости он как правило выступает в качестве окислителя и в виде восстановителя. Есть несколько способов получения водорода.
Заводской способ получения водорода .
1. Электролиз растворов воды солей (поваренная соль NaCl).
2. Пропускание паров поды над жарким древесным углём (Т = 1000 °С):
А на 2-ой стадии водяной газ пропускают над оксидом железа (III) при температуре примерно 450°С:
Часто эту реакцию называют реакцией сдвига.
3. Получение из сетевого газа. База – конверсия метана (главный элемент сетевого газа, СН4) с паром перегретым. В конце концов выходит обратимая смесь, которая именуется синтез-газом. Условия протекания процесса: никелевый катализатор и 1000°С:
Эту реакцию почасту применяют для получения водорода для реакции Габера (синтез нашатырного спирта).
4. Крекинг нефтяных продуктов.
Лабораторный способ получения водорода.
1. Под влиянием разбавленных кислот на металлы, которые стоят в ряду напряжения левее водорода.
2. Электролиз растворов кислот, щелочей на катоде выделяется водород.
Мужской сайт
Натуральный мужчина обязан быть хозяином в доме!
Как добыть водород
Как добыть водород
На Земля водород в чистом виде практически не встречается, и в обычной жизни мы с ним не встречаемся.
получение водорода дома
Однако в соединениях — это второй по количеству атомов компонент в земной коре после кислорода. Все живые создания на Земля, включая нас с вами, приблизительно на 2/3 состоят из водорода.
Основные слова: водород, получение водорода.
Так что такое водород? Каковы его свойства? Как его получают и используют в земных условиях? Можно ли получить водород дома, и как это сделать прекраснее всего? На эти и остальные вопросы мы попытаемся дать ответ в ходе нашей научной работы.
Водород — это Самый аскетический компонент в природе, который состоит из одного протона и крутящегося около него электрона. Первый раз получение водорода упоминается у английского учёного Роберта Бойля, который в первой половине 70-ых годов XVII века проводил реакцию между металлическими стружками и разбавленными кислотами. Российское название «водород» предложил химик М. Ф. Соловьев в первой половине 20-ых годов XIX века — по аналогичности с «кислородом» М. В. Ломоносова. Официальное латинское наименование водорода «Hydrogenium».
В промышленности водород получают преимущественно из ископаемого топлива. Первоочередно это сетевой газ, метан, с которым очень многие из нас может встретится в кухонной комнате, если вас есть кухонная плита. Водород получают из лёгких фракций нефти. 3-ий по популярности источник водорода — это уголь.
Очень доступным для повторения дома считается разложение воды электротоком (электролиз).
Для проведения нашего эксперимента мы взяли старую зарядку на 5 В 750мА и угольные электроды, извлечённые из обыкновенных солевых батареек. Чтобы провести измерения протекающего тока употреблялся мультиметр.
Для сбора и измерения получающихся газов, в бутылки налили воды, и закрепили их на ключевой ёмкости горлышком вниз, погрузив его при этом в электролит. Поэтому, чтобы воздух в бутылку попадать не смог. Всего в ёмкости и бутылках вышло около 1,5 литров воды. Как и ожидалось, с питьевой водой, после подачи напряжения с устройства для зарядки ничего не случилось. Мультиметр показывал практически нулевой ток. Однако, когда в воду добавили 2 чайные ложки соды, электролиз пошёл бодрее, на двоих электродах стали появляться пузыри газа, а мультиметр показал ток 15 мА. с подобным небольшим током за день (24 часа) получилось собрать только 0,11 литра водорода (приблизительно полстакана). Во второй бутылке при этом собралось приблизительно в несколько раз меньше кислорода. Это значит, что в водной массе водорода вдвое больше, чем кислорода.
Наблюдение выделения водорода в результате взаимного действия металлов с разбавленными кислотами было самых первым в истории химии. И его относительно просто повторить дома. Нам для этого потребуется металл, лучше всего энергичнее и кислота. В нашем эксперименте мы подобрали электролит для свинцовых аккумуляторов, который можно отыскать в ближайшем автомагазине и цинк из использованных солевых батареек. Для сбора водорода, как и в случае электролиза, применяли перевёрнутую бутылку с опущенным в воду горлышком. Электролит дополнительно развели водой в соотношении 50 мл раствора серной кислоты на 150 мл. воды. Цинка из батарейки вышло приблизительно 1 г. За 12 часов весь металл растворился и мы получили 0.7 литра водорода.
Другой распространенный способ — взаимное действие металлов с щелочами. Для эксперимента мы подобрали два вида, которые были рядом — кусочки провода и фольгу для запекания. Щёлочь (гидроксид натрия) можно отыскать в бытовых магазинах как средство для очищения труб канализации (КРОТ, к примеру). Установку для получения применяли практически аналогичную, что и в опыте с кислотой и цинком. Раствор в двоих опытах был одинаковым: 20 мл щёлочи и 200 мл воды. В первом опыте применяли проволоку диаметром 1.5 мм, в другом — кусочки фольги. И в том и другом случае масса алюминия была 1 г. В первом опыте получилось получить 1.2 л водорода, заняло это 34 часа. В другом опыте фольга растворилась за 1 час 20 минут, выделив 1.4 л водорода. Из данных опытов делаем вывод, что скорость реакции сильно зависит от поверхностные площади, на которой она происходит. В опыте с фольгой поверхностную площадь была в несколько раз больше, чем в опыте с проволокой. Ещё большей скорости можно достигнуть, если взять алюминий в порошке. В данном случае соотношение поверхностные площади к массе будет самым большим.
Аналогичным образом, в экспериментах по получению водорода наиболее быстрым и доступным способом оказался вариант взаимного действия фольги на алюминевой основе со щёлочью. Но если нужно получать водород постоянно и в значимых количествах, то на первое место должен выйти электролиз, так как он не просит никаких используемых материалов не считая воды. Правда для этого потребуется более серьёзная установка, чем зарядка от телефона и пара бутылок.
В ходе научной работы мы познакомились с очень популярными, но таким редким в бытовых задачах и целях веществом, как водород. Научились получать его всевозможными вариантами и подобрали самый комфортный для выполнения дома — действие средства для очищения труб, имеющего щёлочь, на алюминиевую фольгу.
Еще мы на своем опыте поняли, что водород — горючий и взрывоопасный газ, но им действительно можно заполнять воздушные шарики, чтобы они летали. Правда при этом стоит держать их дальше от открытого огня.
Электролиз воды – это самый устаревший способ получения водорода. Пропуская постоянный ток через воду, на катоде скапливается — водород, а на аноде – кислород. Получение водорода электролизом очень энергозатратный производство, благодаря этому применяется только в тех областях, где данный газ достаточно ценен и нужен.
Получение водорода дома очень легкий процесс и есть несколько вариантов это сделать:
1. Нам потребуется раствор щелочи не нужно пугаться таких названий т.к. все это есть в свободном доступе.
К примеру, средство для очищения труб «крот» прекрасно подойдет по составу.Сыпем в колбу чуть-чуть щелочи и заливаем 100 мл воды;
Тщательно перемешиваем для абсолютного растворения кристаллов;
Добавляем пару маленьких кусочков алюминия;
Ждем около 3-5 минут, пока реакция будет проходить очень быстро;
Добавляем дополнительно несколько кусочков алюминия и 10-20 грамм щелочи;
Закрываем резервуар специализированной колбой с трубкой, которая ведет в резервуар для сбора газа и ждем пару минут пока воздух никак не получится под давлением водорода из сосуда.
2. Выделение водорода из алюминия, пищевой соли и сульфата меди.
В колбу сыпем сульфат меди и немножко побольше соли;
Разбавляем все водой и отлично перемешиваем;
Ставим колбу в водяной резервуар, поскольку при реакции будет выделяться много тепла;
В остальном все необходимо делать также как в первом способе.
3. Получение водорода из воды путем пропускания тока в 12В через раствор соли в водной массе. Это Самый аскетический способ и лучше всего подойдет для бытовых условий. Один недостаток данного варианта в том, что водорода выделяется сравнительно мало.
Итак. Сейчас вы знаете, как получить водород из воды и не только. Вы можете проводить слишком много экспериментов. Не забудьте держаться правил безопасности чтобы не было травм.
Получение водорода дома
В сегодняшней статье описаны одни из самых популярных способы получения недорогого водорода дома.
Способ 1. Водород из алюминия и щелочи.
Применяемый раствор щелочи – едкого кали, либо едкого натра. Выделяемый водород более чистый, чем при реакции кислот с энергичными металлами.
Сыпем в колбу маленькое количество едкого кали либо натра и заливаем 50 -100 мл воды, перемешиваем раствор до абсолютного растворения кристаллов. Дальше добавляем несколько кусочков алюминия. Тот час же начнется реакция с выделением водорода и тепла, в первую очередь слабая, но регулярно усиливающаяся.
Дождавшись пока реакция произойдет более активно, бережно добавим еще 10г. щелочи и несколько кусочком алюминия. Так мы существенно усилим процесс.
Закупориваем колбу, пробиркой с трубкой ведущей сосуд для сбора газа. Ждем приблизительно 3 -5 мин. пока водород вытеснит воздух из сосуда.
Как образуется водород? Оксидная пленка, которая покрывающая поверхность алюминия, при контакте с щелочью рушиться. Так как алюминий считается энергичным металлом, то он начинает реагировать с водой, растворяясь в ней, при этом выделяется водород.
2Al + 2NaOH + 6h3O > 2Na + 3h3^
Способ 2. Водород из алюминия, сульфата меди и пищевой соли.
В колбу сыпем чуть-чуть сульфата меди, и соли. Добавляем воду и перемешиваем до абсолютного растворения. Раствор должен, окрасится в зеленый окрас, если этого не случилось, необходимо еще добавить маленькое количество соли.
Колбу стоит поставить в чашку наполненной холодной водичкой, т.к. при реакции, будет выделятся немалое количество тепла.
Добавляем в раствор несколько кусочков алюминия. Начнется реакция.
Как происходит выделение водорода? В процессе образуется хлорид меди, смывающий оксидную пленку с метала. Вместе с восстановлением меди происходит образование газа.
Способ 3. Водород из цинка и соляной кислоты.
Помещаем в пробирку кусочки цинка и заливаем их соляной кислотой.
Являясь энергичным металлом цинк, взаимодействуя с кислотой, вытесняет из нее водород.
Zn + 2HCl > ZnCl2 + h3^
Способ 4. Производство водорода электролизом.
Пропускаем через водный раствор и проваренной соли переменный ток. При реакции, будет выделятся водород и кислород.
Получение водорода электролизом воды.

Давно хотел выполнить аналогичную штуку. Однако далее опытов с батарейкой и парой электродов не доходило. Хотелось выполнить настоящий аппарат для изготовления водорода, в количестве для того чтобы надуть шарик. Перед тем как делать настоящий аппарат для электролиза воды дома, решил все проверить на модели.
Данная модель не подойдет для полноценной повседневной эксплуатации. Но проверить идею получилось.Итак для электродов я решил применить графит. Идеальный источник графита для электродов это токосъемник троллейбуса. Их полно лежит на конечных остановках. Не забывайте, что один из электродов будет рушиться.
Запиливаем и дорабатываем напильником. Интенсивность электролиза зависит от силы тока и площади электродов. К электродам крепятся провода. Провода обязаны быть тщательно изолированные. Для корпуса модели электролизера прекрасно подходят бутылки из платика. В крышке выполняются отверстия для трубок и проводов. Все тщательно промазывается герметиком.
Для соединений 2-ух ёмкостей подходят отрезанные горлышки бутылок. Их нужно объединить вместе и оплавить шов. Гайки создаются из бутылочных крышек. В 2-ух бутылках снизу выполняются отверстия. Все совмещается и тщательно заливается герметиком.
Как источник напряжения станем задействовать бытовую сеть 220в. Хочу предупредить, что это довольно опасная игрушка. Поэтому, если нет необходимых способностей либо есть подозрения, то лучше не повторить. В бытовой сети у нас ток переменный, для электролиза его стоит выровнять.
Как дома получить водород?
Для этого замечательно подойдет диодный мост. Тот что на фотографии оказался не достаточно мощным и быстро сгорел. Самым лучшим вариантом стал китайский диодный мост MB156 в корпусе из алюминия.
Диодный мост очень разогревается. Потребуется активное охлаждение. Кулер для компьютерного процессора подойдёт идеально. Для корпуса можно применять подобающую по размерам распаячную коробку. Реализуется в электрических товарах.
Под диодный мост нужно подложить парочку слоев картона. В крышке распаячной коробки выполняются нужные отверстия. Так смотрится установка в сборе. Электролизер запитывается от сети, вентилятор от многофункционального источника питания. В качестве электролита применяется раствор пищевой соды. Здесь не забывайте, что чем больше концентрация раствора, тем больше скорость реакции. Однако при этом выше и нагрев. Причем собственный взнос в нагрев будет вносить реакция разложения натрия у катода. Эта реакция экзотермическая. В результате неё будет возникать водород и гидроксид натрия.
Тот аппарат, что на фото выше, особенно сильно нагревался. Его случалось иногда отключать и ожидать пока остынет. Проблематику с нагревом получилось отчасти решить путем охлаждения электролита. Для этого я применил помпу для настольного фонтана. Длинная трубка проходит из одной бутылки в иную через помпу и ведро с холодной водичкой.
Место подключения трубки к шарику отлично снабдить краником. Реализовываются в зоомагазинах в отделе для аквариумов.
Ключевые знания по традиционному электролизу.
Принцип экономности электролизёра для получения газа h3 и O2.
Наверное каждый знает, если опустить два гвоздя в раствор пригодной для питья соды и подать на один гвоздь плюс, а на другой минус, то на минусе будет выделяться Водород,а на плюсе Кислород.
Сейчас наша задача найти этот подход, дабы получить побольше этого газа и истратить при этом небольшое количество электрической энергии.
Урок 1. Напряжение
Разложение воды начинается при подаче на электроды немножко побольше 1,8 вольта. Если подавать 1 вольт, то ток почти не идёт и не выделяется газ, а вот когда напряжение подходит к значению 1,8 вольта, то ток резко начинает расти. Это называют очень маленький электродный потенциал при котором начинается электролиз. Благодаря этому- если мы подадим 12 вольт на эти 2 гвоздя — то такой электролизёр будет жрать много электрической энергии, а газу будет недостаточно. Вся энергия уйдёт в нагрев электролита.
Для того. чтобы наш электролизёр был выгодным — нужно подавать не больше 2-х вольт на ячейку. Благодаря этому, если у нас 12 вольт — мы делим их на 6 ячеек и приобретаем на любой по 2 вольта.
А сейчас упрощаем — просто разделим ёмкость на 6 частей пластинами- в результате выйдет 6 ячеек, соединённых постепенно на любой ячейке будет по 2 вольта каждая внутренняя пластина с одной стороны будет плюсом, а со второй минусом. Итак — урок номер 1 усвоили = подавать небольшое напряжение.
Сейчас 2-ой урок экономности: Расстояние между пластинами
Чем больше расстояние — тем больше сопротивление, тем больше потратим тока для получения литра газа.Чем меньше расстояние — тем меньше потратим Ватт в Час на Литр газа. Дальше буду пользоваться собственно данным термином — показатель экономности электролизёра / Из графика видно, что чем ближе находятся пластины друг к другу — тем меньше напряжение требуется для прохождения одного и того же тока. А как все знают выход газа прямо пропорционален количеству тока прошедшего через электролит.
Перемножая более небольшое напряжение на ток — мы получаем меньше ватт на то же кол-во газа.
Сейчас 3-й урок. Площадь пластин
Если мы возьмём 2 гвоздя и применяя первые два правила разместим их недалеко и подадим на них 2 вольта — то газу выйдет крайне мало, так как они пропустят довольно мало тока. Попробуем при тех же условиях взять две пластины. Сейчас кол-во тока и газа будет увеличено прямо пропорционально площади таких пластин.
Сейчас 4-й урок: Концентрация электролита
Применяя первые 3 правила возьмём большие металлические пластины на маленьком расстоянии один от одного и подадим на них 2 вольта.И опустим их в водичку, добавив одну щепотку соды. Электролиз пойдёт, но очень вяло, вода будет разогреваться. Ионов в растворе много будет, сопротивление будет небольшое, нагрев станет меньше а кол-во газа становится больше
Это интересно

Японские демоны
Они — в мифология Японии так называют злобных человекообразных чудовищ, схожих на христианских чертей и бесов. …

Арахна — дочь Идмона
Лидийская женщина, дочь Идмона— красильщика пурпуром из Колофона, «обитала в ничтожных Гипепах». Славилась как искусная ткачиха и вышивальщица: …
Cнежный человек в глыбе льда
Сенсационное сообщение про то, что снежный человек есть в действительности, выполнили американские ученые мужи. Согласно их заявлениям, они …

Славянские богини
Культура славяно-арийского народа изначально отличалась великим своеобразием, которое в собственных трудах отмечали все экспериментаторы, начиная от Геродота и …

Дом в Амстердаме сделан 3d-принтером
3D Print Canal House – оригинальная знаменитость Амстердама, располагающаяся по адресу Asterweg 49. Проект Research & …

Образ и фирма
Как Вы подбираете компанию, которой доверите подарочную упаковку, который предназначен для дорого человека? Быстрее всего, Вы спросите у друзей, …

Одиссей и Алкиной
Одиссей попал во власть всех ветров. От неминуемой смерти Одиссея снова спасла богиня Афина, приказавшая ветрам …
» Дома
Как получить водород дома
Как получить водород?
Производство водорода – одна из основных образующих цепочек водородной энергетики. Водород в чистом виде, почти не попадается в природе, благодаря этому он должен извлекаться из иных веществ на основе химии разными способами и способами.
Как получить водород: способы
- Паровая конверсия метана и сетевого газа: пар перегретый при большой температуре (700 – 1000 градусов по Цельсию) перемешивается с метаном под давлением, в наличии катализирующего вещества.
- Газификация угля: один из старых вариантов получения водорода. Без доступа воздуха, при температуре 800 – 1300 градусов по Цельсию греют уголь одновременно с паром перегретым, при этом из воды уголь вытесняет кислород. На выходе выходит углекислый газ и водород.
- Электролиз воды. очень обыкновенный способ получения водорода. В емкость наливается раствор соды, в который помещается 2 электрических элемента, один отвечает минусу – катод, другой плюсу – анод. В этот раствор подается электричество, которое разлаживает воду на составляющие – водород выделяется на катоде, а кислород на аноде.
- Пиролиз: разложение воды на водород и кислород без доступа воздуха и при большой температуре.
- Выборочное окисление: сплав металлов алюминия и галлия образовывают в специализированные брикеты, которые помещают в емкость с водой, в результате химреакции образуется водород и окись алюминия. Галлий применяется в сплаве для устранения окисления алюминия.
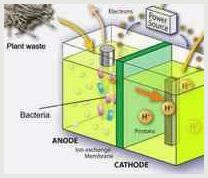
- Биотехнологии: еще в двадцатом веке было найдено, что если водорослям хламидомонадам не хватит кислорода и серы в процессе деятельности, то они бурно начнут выделять водород.
- Глубокий газ планеты: в недрах земли водород может располагаться в чистом газообразном виде, но его выработка оттуда не целесообразна.
Как из воды получить водород
Самым обычным способом получения водорода из воды считается электролиз. Электролиз — химический процесс, при котором раствор электролита, под влиянием электротока, делится на важные части, другими словами в нашем случае вода делится на водород и кислород. Для этого применяется раствор соды в водной массе и два элемента – катод и анод, на каких и будут выделятся газы.
Как добыть водород безопасно дома?
На детали подается напряжение, на аноде выделяется кислород, а на катоде водород.
Как получить водород дома
Реактивы применяются довольно обычные – купорос (медный), поваренная соль, алюминий и вода. Алюминий можно взять из под пивных банок, однако прежде, его необходимо обжечь, чтобы избавится от пластиковой пленки, которая мешает реакции.
Потом отдельно готовится раствор купороса, и раствор соли, раствор купороса голубого цвета, перемешивается с раствором соли, в конце концов выходит раствор в зеленом цвете. Потом в этот зеленый раствор бросаем кусочек фольги на алюминевой основе, около него появляются пузыри – это водород. Также замечаем, что фольга покрылась красным налетом, это алюминий вытеснил медь из раствора. Для того, чтобы собрать водород для собственных целей, применяйте бутылку с пробкой, в которую заблаговременно вмонтирована не широкая трубка, через какую и будет выходить газ.
А сейчас, внимание! Меры предосторожности. Так как водород взрывоопасный газ, опыты с ним необходимо бывать на улице, а второе реакция получения водорода проходит с большим выделением тепла, раствор может разбрызгиваться и вас просто обжечь.
Как получить перекись водорода
- В лаборатории перекись водорода получают при помощи реакции: ВаО2 + Н2 SО4 = BaSO4 + H2 O2 .
- В масштабах промышленности ее получают при помощи электролиза серной кислоты, в процессе которого образуется надсерная кислота, которую, в конце концов, разлаживают на серную кислоту и перекись водорода.
- Как получают водород в лаборатории еще: часто водород в лаборатории получают взаимным действием цинка и соляной кислоты: Zn + 2HCl = H2 + ZnCl2 .
Надеюсь, с данной статьи вы вынесли те данные, которая вам была нужна, и еще раз предупреждаю – будьте осторожны с самыми разными опытами и экспериментами с водородом!
Как легко и быстро получить водород дома
- Кое что из школьного курса химии.
- Позвонил приятель,и попросил меня сделать или дать настоящий рецепт химреакции,позволяющей легко и безопасно получить водород дома.
Не зная истинных целей использования водорода, я придумал,точнее вспомнил из школьного урока химии ,реакцию получения водорода ,достаточного для того, чтобы надуть несколько детских воздушных шариков Заблаговременно хочу предупредить — делать это стоит на чистом воздухе и не забывать что водород — крайне опасный газ. Даже с несколькими литрами, оказавшимися в резиновой оболочке необходимо обращаться крайне осторожно. А в помещении с ним возиться не стоит, так как он легче воздуха и, улетев в необходимом количестве, стремится образовать под поверхностью потолка слой гремучего газа.
Учтя данные меры предосторожности, приступаем. Реактивы очень простые, доступные и относительно неопасные — медный купорос из магазина хозяйственных товаров, поваренная соль, алюминий и вода. Алюминий я взял из использованных пивных банок. Правда, их понадобилось обжечь чтобы освободится от пластиковой плёнки, которая не даёт алюминию реагировать с содержимым банки. Первый великолепный фокус можно взглянуть, если отдельно сделать раствор медного купороса (голубой) и раствор поваренной соли (бесцветный). Сливаем в одну банку — раствор стал зелёным. Если сейчас в него кинуть кусочек алюминевой фольги, увидим как раствор около него пенится — это выделяется водород, а сам кусочек фольги покрывается красным налётом — алюминий вытеснил из раствора медь. Более того, алюминий окислился — возникла белесая взвесь. Ещё одно предупреждение — процесс экзотермический. Говоря по другому, идёт с выделением тепла. Т.е. раствор со временем разогревается. А если взять во внимание то, что скорость этой реакции возрастает с ростом температуры, очень запросто получить реакцию идущую вразнос . Как у меня и вышло. Первый результат — гейзер, который стоя на улице, плевался бурым кипятком. Но вот концентрация выбрана, выбрана начальная температура и можно видеть результат:
Берете бутылку из под шампанского и закрываете пробкой с заблаговременно вставленой в неё трубкой диаметром 5-8мм.С трубки выходит водород,которым вы можете надуть привлекательные воздушные шары,а потом ,гуляя с ребенком одновременно с ним отпустите их в небо.Поверте:-восторг и хохот вашего ребенка стоит таких несложных действий.
Новая недорогая процедура получения водорода дома

Водородные топливные детали могут стать еще одной альтернативой обычным аккумуляторным батареям, применяемым в электрических машинах. Уже есть прототипы авто, которые работают на водороде. Но сложность получения данного вещества дома пока замедляет формирование этого экологично чистого энергетического источника.
Передвинуть прогресс в этом направлении смогли ученые мужи из Стэндфордского университета. Они создали миниатюрный электронный сплиттер, который расщепляет воду на кислород и водород, получая питание только от одной 1,5-вольтовой батарейки. Сплиттер состоит из никелевого и железного электродов. Он прекрасно функционирует даже при температуре 20 градусов.
Современная технология уникальна тем, что в процессе выработки водорода не принимают участие не дешёвые материалы, как это происходит в промышленных расщепителях воды. Стоит еще сказать, что устройство применяет очень мало электроэнергии.
Катализатор на основе никеля и железа был придуман аспирантом Стэндфордского университета Мин Гуном. Дальнейшим шагом в исследовании будет применение заместь батарейки солнечного фотоэлемента. Это намного больше сделает дешевле добычу водорода.
Первые разработки машин на топливных элементах начались еще в 60-х годах ушедшего века. Однако это по большей части были лишь прототипы. Но уже в следующем году такие производители машин как Toyota, Honda и Hyundai задумывают запустить в производство серийные модели машин на водородных топливных элементах. И разработка ученых из Стэнфорда им как раз на руку.



